ADEが発生するほうが選ばれ
前回の以下の記事で、
> 要するに、「今は戦時だ」ということがお伝えできていれば幸いです。
と書きました。
厚生労働省発表の「コロナワクチンが原因の日本の死亡者はゼロ」の資料を見て思う「戦時下感」。そして、中国軍の生物兵器開発の公式資料に思うその現実感
投稿日:2021年7月6日
こういうのを「比喩」だと思われる方がいらっしゃるかも知らないですが、これは比喩ではないです。
文字通りの意味において「戦時下」と書いています。
それで、その特徴を示す現実のひとつをご紹介させていただこうかと思います。
以前メルマガで書かせていただいたものですが、もう少し多くの方に知っておいていただいたほうがいいことなのかもしれないとも思いました。
書かせていただく内容は、ファイザー社のコロナワクチンについてですが、
「臨床試験では、複数のバージョンが同時に試験されていて、《そのひとつ》が選ばれて、実際に人々に打つほうのワクチンとして採用となった」
という経緯があります。
ファイザー社の臨床試験書を見ていて気づいたことですが、最初に簡単に書きますと、
・ひとつのほうのバージョンは、「ADE (抗体依存性増強)を起こさない可能性のあるもの」だった
・もうひとつは、「ADEを起こす可能性があるもの」だった
のですが、本採用されたのは「 ADE を起こす可能性があるほう」となりました。
ADE については、以下のふたつの記事などをご参照くだされば幸いです。
人類の大量死につながる可能性を否定できない ADE (抗体依存性増強)についてのメカニズム…
投稿日:2021年4月27日
大阪大学が「抗体依存性増強の研究」論文を発表。そこから想像できる「ワクチン接種拡大と共に死者数が増加する理由」。そして、今のワクチンではADEは避けられないことも
投稿日:2021年5月31日
ADE とは、簡単に書けば、ある種類のウイルスなどのワクチンを接種した場合、その後、再感染した際に症状の度合いが非常に強くなる、というものです。
私は、 ADE という言葉さえ、このコロナワクチンが展開されてから初めて知ったことですが、医師や医学者ならどなたでもご存じのことのようで、デングウイルスなどいくつかのワクチンでは、この ADE があるために、ワクチン開発が停滞しています。
そして、
「コロナウイルスのワクチンも ADE を起こすもののひとつ」
でした。
新型コロナウイルスということではなく、すべてのコロナウイルスのワクチンが、ADE を防ぐことができずに開発が中止・延期されています。
そのために、これまで一度もいかなるコロナウイルスに対してのワクチンの開発も成功したことがありませんでした。
現在出回っているあらゆる種類のコロナワクチンも、そこに「抗体」を作る機能があるかぎり、 ADE を防ぐメカニズムはないと思われます。
これから出るものについてはわかりません。
ただし、抗体を作る機能がない「水ワクチン」なら ADE は起こりようがないです。
水ワクチンとかいきなり書いてもよくわからないかもしれないですが、以下はひとつの報道のタイトルです。
・中国製ワクチンは「水ワクチン」?…シンガポール「シノバック接種した人はコロナ検査もう一度受けて」 (朝鮮日報 2021/07/03)
仮にこの通りだとして、こういう「感染予防としての抗体産生機能が搭載されていない」ようなものなら、ADE は起きようがありません。
矛盾するように聞こえるかもしれないですが、「コロナウイルス感染症の最重症化を防ぐためには、ワクチンで予防しない」という方法しか現在までのところは存在していません。
「感染を防ぐ」ほうではなく、「最重症化を防ぐ」ほうの話です。
残念ながら、現行のコロナワクチンでは、その程度や、どのくらいの人たちに起き得るかということは今はわからないものの、数や規模を別にすれば「必ず起きると予測される」ものです。
ですので、ワクチン抗体によってのコロナウイルスの予防は、最も厄介な状態を導く可能性が高くなる方法でもあり、これを否定できる医学者はいないはずです。
それはもうメカニズムとして医学の歴史の中で確立されているものですから、否定しようがない。
先ほどの過去記事でご紹介しました大阪大学や免疫学フロンティア研究センターなどの共同研究である「新型コロナウイルスの感染を増強する抗体を発見」というプレスリリースには、明確に以下のように書かれています。
> 感染増強抗体の認識部位は現行のワクチン抗原にも含まれている。
「 ADE を誘発する部位は、現行のワクチン抗原にも含まれている」と書かれてあり、そして、それがどこのメーカーのワクチンと書かれているわけではないわけで「全部」です。
水ワクチン以外は全部 ADE が起き得る可能性を排除できないと思われます。
それはともかく、上の大阪大学などの共同研究のプレスリリースにおいての、先ほどの「感染増強抗体の認識部位は現行のワクチン抗原にも含まれている」の記述の後には、以下の表現が続きます。
> 感染増強抗体の産生を誘導しないワクチン抗原を開発することが望ましい。
> 本研究で明らかになった感染増強抗体の認識部位を改変することで、感染増強抗体の産生を誘導しないワクチン開発が可能になると期待される。
この「感染増強抗体の産生を誘導しないワクチン」は、実は「開発されていた」のです。
ファイザー社によって。
残念なことは、「それが採用されなかった」ということだけです。
つまり、今でも、ADE を起こさないワクチンはファイザーの研究室(かどこか)にはあるはずです。
まあ、ポリエチレングリコールにくるまれた mRNA を打つという根本的な害悪性についてはそのバージョンも同じですが、少なくとも、
「副反応・副作用ではない二度目に遅いかかる ADE という悲劇を回避できた可能性のあるワクチン」
が、ファイザー社のどこかに眠っています。
そのことをご説明させていただきたいと思います。
決して平易な話ではないです。
それに、私の解釈が間違っているかもしれないですし、最終的な判断は、皆様にお委ねしますが、「最終的に選ばれたのは ADE を起こすほうのワクチンだった」という可能性があることを知って頂ければと思います。
ここからです。
試薬 BNT162b「1」と試薬 BNT162b「2」
なかなかややこしい話となるかもしれないですが、基本的には、
「大阪大学などによる抗体依存性増強の研究の論文」
と
「厚生労働省のファイザー社コロナワクチン特例承認書類の内容」
を照らし合わせていきます。
厚生労働省の「特例承認書類」については、正式名は、「コミナティ筋注 ファイザー株式会社 特例承認に係る報告書」といい、以下の記事で取りあげています。
厚生労働省の医薬品部局による「コロナワクチン特例承認」書類で知る「闇」(というか本当に黒い部分が多いので)…
投稿日:2021年6月22日
大阪大学の論文のプレスリリースには、先ほども書きましたように、以下のように記されています。
> 感染増強抗体の認識部位は現行のワクチン抗原にも含まれている。
つまり、現在使われているワクチンは、ADE を起こす可能性があると述べられています。
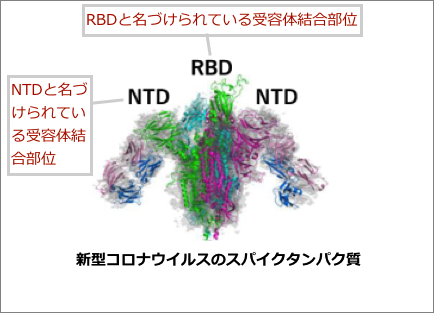
ここからがちょっと面倒くさい話ですが、新型コロナウイルス(のスパイクタンパク質)の部位は、
・RBD(受容体の結合部位)
・NTD (受容体の結合部位)
からなっています。
大阪大学などの研究から図をお借りしますと、以下のようになっています。
大阪大学などの研究のプレスリリースには以下のように書かれてあります。
> 中和抗体は RBD を認識するのに対して、
> 感染増強抗体は NTD の特定の部位を認識することが明らかとなった。
つまり、
・ADE を起こす感染増強抗体は、上の図の「 NTD 」というほうの受容体の結合部位を認識する
ということで、この NTD というほうが、抗体依存性増強と関係する。
そして、 中和抗体、つまり感染予防となるとされる抗体のほうは「 RBD を認識する」とプレスリリースにはありまして、この RBD だけを認識するものであれば、抗体依存性増強は起きにくい可能性がある。
このふたつのことがわかります。
図で示しますと、以下のようなことになるでしょうか。
さて、ここから、厚生労働省によるファイザー社ワクチンの特例承認書の内容に入ります。
その前に大前提として、現在、日本で接種が進んでいる実際に使用されているファイザー社ワクチンの正式名称の型番は、
BNT162b2
です。
末尾が「 2 」のものです。
この末尾の数字がとても大事になってきます。
末尾が「 1 」のものも出てくるからです。
日本で実際に使われているファイザー社ワクチンが、この末尾が「 2 」の BNT162b2 かどうかは、以下の国立感染症研究所の 5月10日時点の「新型コロナワクチンBNT162b2(Pfizer/BioNTech)を接種後のCOVID-19報告率に関する検討」というページの冒頭でわかります。
> 国内に導入された新型コロナワクチン BNT162b2 の臨床的効果を迅速に評価することを目的として
とあるように、日本国内に導入され現在使われているファイザー社新型コロナワクチンは「 BNT162b2 」です。
ここで再び、厚生労働省の「特例承認書」を見てみます。
末尾が「 2 」のほうです。
さきほどの、RBD というものと NTD というものを思い出されて読まれて下さると幸いです。
特例承認書の 22ページには以下のようにあります。
> なお、本剤は SARS-CoV-2 の S タンパク質の全長体をコードする mRNA であり、BNT162b1 は SARS-CoV-2 の S タンパク質の RBD をコードする mRNA である。

コミナティ筋注 ファイザー株式会社 特例承認に係る報告書 22ページ
とあります。
ここでの「本剤」というのが、現在、日本で使われているほうで、末尾が 2 のほうです。
文章をひとつずつもう一度書きます。
・本剤は SARS-CoV-2 の S タンパク質の全長体をコードする mRNA
・BNT162b1 は SARS-CoV-2 の S タンパク質の RBD をコードする mRNA
下のほうの文章には、
「 BNT162b1 」
と、末尾の数字が「 1 」とあり、現在日本で使われている末尾が「 2 」のファイザー社ワクチンとは「異なるワクチン」が、比較として臨床で使われていたことがわかります。
「 1 」とありますので、ごく普通に考えれば、現在使用されている「 2 」のひとつ前の開発バージョンか何かだとは思いますが、開発の順番はともかく、「異なる2種類のワクチンで比較された」ことになります。
この文書には、
> 18 歳以上 55 歳以下及び 65 歳以上 85 歳以下の健康人を対象に、本剤( BNT162b2 )の安全性、忍容性及び免疫原性の検討を目的とした無作為化観察者盲検、プラセボ対照並行群間比較試験が米国の 4 施設で実施された。
> 被験者は、各グループ(本剤又は BNT162b1 の用量別及びプラセボと年齢層別の組合せ計 13 グループ)ごとに、無作為化された。
とあり、これはアメリカでの試験であり、
・本剤(末尾が 2の BNT162b2で、現在日本で使われているほう)
・BNT162b1(末尾が 1の採用されなかったほう)
での比較試験とあります。
文書では、「本剤」とあり、やややこしいですので、それを正式名にして、もう一度、書きますと、
・BNT162b2 はスパイクタンパク質の全長体をコードする mRNA
・BNT162b1 はスパイクタンパク質の RBD をコードする mRNA
とあります。
ここで、大阪大学等の研究を思い出してみます。
現在日本で使われている BNT162b2 は、「全長体をコードする」とありますので、「すべて含まれている」ということになり、つまり、
「 RBD も NTD も含まれている」
ということになります。
以下の図をもう一度示させていただきますと、「感染増強抗体の産生を誘導する」部位、つまり ADE を引き起こす可能性と関係する部位である NTD も含まれているということです。
しかし、採用されなかったほうのワクチンである、末尾が「 1 」の BNT162b1には、「 RBD をコードする」とだけ書かれており、ADE を引き起こす可能性がある部位の NTD はコードしないと読めます。
ということは、
「この採用されなかったワクチンなら ADE が引き起こされない可能性がある」
ということで、大阪大学などの研究のプレスリリースには、
> 感染増強抗体の認識部位を改変することで、感染増強抗体の産生を誘導しないワクチン開発が可能になると期待される。
とありますが、くしくもファイザー社は、この
「感染増強抗体の認識部位を改変することで、感染増強抗体の産生を誘導しないワクチンの開発に成功していた」
のでした。
つまり、「 ADE を引き起こさないコロナウイルスのワクチン」を、おそらく世界で初めて開発したということになるのです。
これは素晴らしいことです。
ただ、ひとつ残念だったことは、
「そのワクチンは現実には使われなかった」
と。
試験後に採用され、世界中で現在接種されているのは、
「スパイクタンパク質のNTD もコードする BNT162b2 」
であり、感染増強抗体の認識部位が含まれているほうで、つまり、
「 ADE を引き起こす可能性が、より高いほうが本採用となった」
のでした。
本採用されなかった BNT162b1 のほうなら、それ自体が有害であるスパイクタンパク質を産生する mRNA を接種することの有害性は変わらなくとも、ADE を引き起こす抗体が認識しない部位だけがコードされるものだったわけで、少なくとも ADE は回避された可能性が高いです。
試験の中で、 ADE を引き起こさない可能性があるほうのバージョンは最終的に採用されなかった。
なお、独立行政法人 医薬品医療機器総合機構のページからリンクされている資料に、
・SARS-CoV-2 mRNA Vaccine 個々の試験のまとめ
というものがあり、ここには、各国の試験の状況が書かれていますが、ドイツでの試験では、これに加えて、さらに末尾の英数字が異なる、
・BNT162a1
・BNT162c2
という、ふたつの異なるバージョンが試験されていたことも記載されています。語尾が「 a1 」と「 c2 」のバージョンです。
こちらの BNT162a1 と BNT162c2 については、この文書では試験についてふれられていませんので、どのようなものかはわかりません。
いずれにしましても、「試験の段階では ADE を起こす可能性が低いワクチンは存在していた」と考えられます。
そして、今回のことでわかるのは、新型コロナのスパイクタンパク質を作り出すタイプのワクチンは、
1. RBD と NTD のどちらもコードするワクチン
2. RBD のみをコードするワクチン
3. NTD のみをコードするワクチン
という3つの種類のワクチンを作ることが可能であるということでした。
これはそれぞれ以下のようになります。
1. RBD と NTD のどちらもコードする → 感染抑制の効果が期待できるが、後に、抗体依存性増強が引き起こされる可能性がある
2. RBD のみをコードする → 感染抑制の効果が期待でき、抗体依存性増強を引き起こす可能性が低い
3. NTD のみをコードする → 感染抑制効果はなく、抗体依存性増強に特化したワクチン
「3」は、まるで完全な生物兵器ですが、幸いなことに、これはどの国でも使われていません(おそらく)。
実際に使われているのは「1」です。
試験での経緯の詳細はともかくとしても、「残念なほうが本採用となった」ということをご説明させていただきました。
それにしても、今回参照させていただいている厚生労働省の「特例承認書類」は、読めば読むほど「味がある」ものです。読み直すたびに「新しい発見」があり、「新たな感動」がある。
それに伴い勉強もすることになるという、厚生労働省のこの特例承認書類は、私たちを成長させてくれるものでもあります。
今回この書類から発見したことを少しだけ書いておきます。「不純物」の項目です。
なぜ、二本鎖 RNAが不純物として検出されるのか
私は、もともと RNA だの DNA だのの知識がきわめて乏しい人で、ゲノムのことを中学生(今だと小学生も?)並みに知るようになったのは、遺伝子コロナワクチンの大規模接種が始まってからでした。
新型コロナウイルスは、 1本鎖RNAウイルスというもので、私は、RNA とはおおむね一本鎖だと思い込んでいたのですが、実際には核酸の分類は以下のように 7種類と、国際ウイルス分類委員会で決められているようです。
・2本鎖DNA
・1本鎖DNA
・2本鎖RNA
・1本鎖RNA プラス鎖
・1本鎖RNA マイナス鎖
・1本鎖RNA 逆転写
・2本鎖DNA 逆転写
International Committee on Taxonomy of Viruses
2本鎖DNAとか、1本鎖RNAとかは何となくわかりますが、1本鎖RNAにも、プラス鎖とマイナス鎖があったりとか複雑です。
あるいは、「 1本鎖RNA 逆転写」( HIV など)とか「2本鎖DNA 逆転写」(B型肝炎ウイルスなど)とかとなると、理解はさらに難しいですが、それぞれの解説は、2020年3月の日経メディカルの記事にわかりやすく書かれています。
さて、それらの分類はともかく、ファイザー社のワクチンは、1本鎖RNAウイルス(プラス鎖というほうの、ゲノム本体そのものが mRNAとして働くほう)に分類されますので、そのワクチン内には普通に考えても、
「 1本鎖RNAしか見当たらないはず」
のような気がします。
しかし、厚生労働省の「特例承認書類」の 5ページには以下のようにあるのです。
> 2.1.5.2 目的物質関連物質/目的物質由来不純物
目的物質由来不純物は、二本鎖 RNA とされ、原薬の規格及び試験方法により適切に管理されている。
「なんで、二本鎖 RNA が一本鎖 RNAワクチンの中に目的物質由来不純物として入ってるん?」
と思ってしまったのです。
「目的物質由来」の不純物ということは、中和抗体を作るための 1本鎖 mRNAのワクチンを製造する中での不純物ということになるとしか解釈できないのですが、1本 鎖RNAワクチンの中に「 2本鎖 RNA」が不純物として入っている。1本鎖 RNAって、何らかの課程で、2本鎖 RNAを作り出すメカニズムを持っているということなんでしょうか。
2本鎖RNAとは、以下のようなものだと辞書には書かれてあります。
二本鎖RNA
二重らせん構造をとる特殊な RNA。2本の相補的な塩基配列をもつ RNA 鎖が互いに逆向きに結合したもの。
RNA ウイルスに特有の構造で、宿主の細胞内で複製する過程でみられる。また、一部の RNA ウイルスではゲノムとして存在する。(二本鎖RNAウイルス)
うーん。
なぜ、二本鎖 RNAが不純物として入っているのかは、ゲノムの知識に乏しい私にはわかりようがないですが、詳しい方なら、おわかりになるのでしょうか。
> 宿主の細胞内で複製する過程でみられる
というような働きなど、こういうことは、ごく普通のことなのですかね。
それにしても、ファイザー社のワクチンには「検出される不純物がかなり多い」ことがわかります。
以前、以下の記事で、やはり厚生労働省の「特例承認に係る報告書」の英アストラゼネカ社のものについてご紹介しました。
ウイルスベクターDNAワクチンの破壊力。「他人のヒトゲノム8%を注射される」ことで起き得る可能性のあるあまりにも多い本作用
投稿日:2021年6月25日
アストラゼネカ社のワクチンの不純物は以下のようになっていました。
アストラセネカ社のワクチンの製造工程由来不純物
製造工程由来不純物は、宿主細胞由来 不純物A* 、宿主細胞由来 不純物B* 、不純物C* 、不純物D*、不純物E* 及び 不純物F* とれさた。 (特例承認に係る報告書 6ページ)
ファイザー社の不純物のほうは、以下のようになっています。
ファイザー社ワクチンの不純物
2.1.5.2 目的物質関連物質/目的物質由来不純物
目的物質由来不純物は、二本鎖 RNA とされ、原薬の規格及び試験方法により適切に管理されている。2.1.5.3 製造工程由来不純物
製造工程由来不純物は、鋳型 DNA、 工程由来不純物A※ 、工程由来不純物B※、工程由来不純物C ※、ATP、CTP、GTP、m1ΨTP、 、工程由来不純物D※ 、工程由来不純物E※ 、酢酸マグネシウム、塩化カルシウム、硫酸アンモニウム、Triton X-100、トリス塩酸緩衝液、グリセロール、塩化ナトリウム、塩化カリウム、工程由来不純物F※、工程由来不純物G※、及び及び 工程由来不純物H※ とされた。残存鋳型 DNA は、原薬の規格及び試験方法により適切に管理されている。 工程由来不純物A※及び 工程由来不純物B※は、製造工程において十分に除去されることが確認されている。
また、ATP、CTP、GTP、m1ΨTP、工程由来不純物C ※、工程由来不純物D※ 、工程由来不純物E※ 、酢酸マグネシウム、塩化カルシウム、硫酸アンモニウム、Triton X-100、トリス塩酸緩衝液、グリセロール、塩化ナトリウム、塩化カリウム、 不純物F※、工程由来不純物G、 及び 工程由来不純物H※ は、精製工程で不純物を除去できないと仮定しても、本剤の接種量に対して安全性に問題がない量であることが確認されている。 (特例承認書類 5ページ)
このうち、「工程由来不純物C」と「工程由来不純物G」は、なぜか読めないほどの極めて小さな文字で書かれていました。
繰り返し出てきても、同じように「読めないような大きさ」で書かれています。下のように本当に虫メガネとかじゃないと読めないのです。
この特例承認報告書では、
> 精製工程で不純物を除去できないと仮定しても、本剤の接種量に対して安全性に問題がない量である
と大部分の不純物が取り除かれていない可能性が明記されています。
いろいろな不純物が書かれていますね。
・鋳型 DNA
とか。
「 Triton X-100 ってなんだ?」と思い、英語版の Wikipedia を見てみますと、
> Triton X-100分解生成物は、野生生物に作用する可能性のあるホルモン様(エストロゲン模倣)活性を持っており、実際に生態毒性があることが判明している。
とかあり、不純物のほうもクセがありそうな感じです。
すっかりコロナワクチンの特例承認書が愛読書となっている最近で、厚生労働省に成長させてもらっている自分を感じますが、皆様も座右の書として愛読されることをお勧めします。
現在起きていることがよくわかります。
>> In Deep メルマガのご案内
In Deepではメルマガも発行しています。ブログではあまりふれにくいことなどを含めて、毎週金曜日に配信させていたただいています。お試し月は無料で、その期間中におやめになることもできますので、お試し下されば幸いです。こちらをクリックされるか以下からご登録できます。
▶ ご登録へ進む